钠电–为什么磷酸盐阴离子材料比层状过渡金属氧化物具有更高的氧化还原电位?利用分子轨道理论解释
一.为什么磷酸盐基多阴离子阴极材料通常比层状过渡金属氧化物具有更高的氧化还原电位
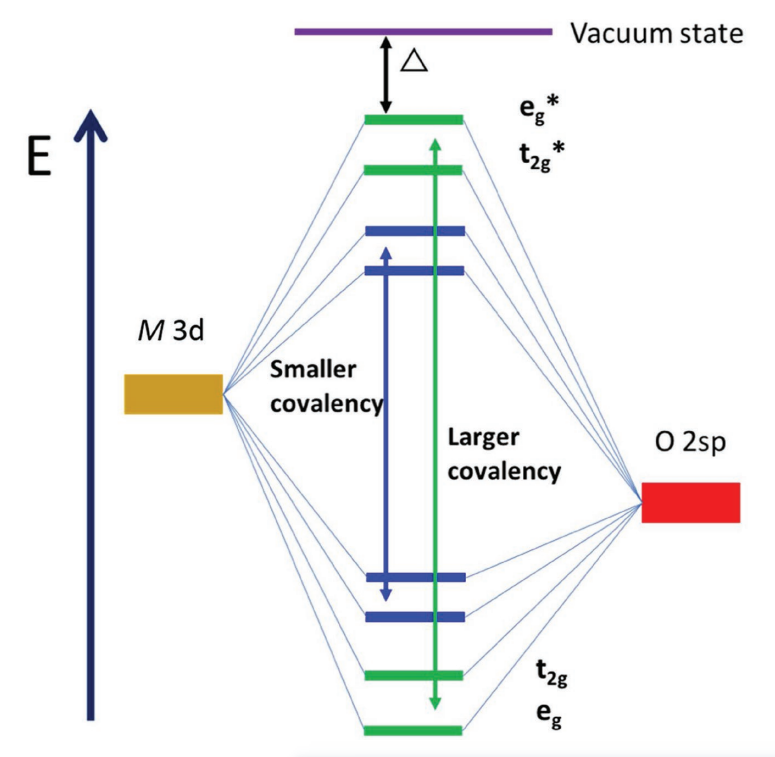
答:下图是过渡金属M3d和O2sp轨道相互作用的能级示意图。M和O之间的共价相互作用导致分子轨道分裂,形成成键轨道和反键轨道,反键轨道主要为M的3d特征(上半部分),成键轨道主要为O的2sp特征(下半部分)。当M-O之间的共价越强,反键轨道和成键轨道之间的能量分裂越大,反键轨道被推高。因此,反键轨道和真空之间的能量差(Δ1)会更小,因此会导致更低的氧化还原电位。当引入另一个原子X形成M-O-X键时,诱导效应就会发挥作用。如果X的电负性比M强,则M-O之间的共价会降低,从而有更大的Δ2,产生更高的电压。
Δ是将一个电子驱动到真空状态所需的能量,与电压成正比。
那么进一步理解的关键在于,成键轨道和反键轨道是什么?
这就涉及到了分子轨道理论。
二.什么是分子轨道理论
分子轨道理论(Mocular Orbital Theory):
a.从分子的整体性来讨论分子的结构,认为原子形成分子后,电子不再属于个别的原子轨道,而是属于整个分子的分子轨道,分子轨道是多中心的;
b.分子轨道由原子轨道组合而成,形成分子轨道时遵从能量近似原则、对称性一致(匹配)原则、最大重叠原则;
c.在分子中电子填充分子轨道的原则也服从能量最低原理、泡利不相容原理和洪特规则。
d.分子轨道理论是对于价键理论的补充。
我们将从三个例子的展开来了解分子轨道理论的运用:
1.氢分子的分子轨道
两个氢原子使用各自的1s轨道构成氢分子的分子轨道。当两个轨道重叠时,两个分子轨道就形成了。
其中一个分子轨道,是由两个1s轨道的波函数相加得到的。这样的轨道叫做成键轨道。成键轨道中的电子,能量比原本的1s轨道中的电子低。
另一个分子轨道,是由两个1s轨道的波函数相减得到的。这样的轨道叫做反键轨道。反键轨道中,两个原有轨道重合的部分电子云密度几乎为零。这个轨道中的电子能量比原来的1s轨道中的能量高。
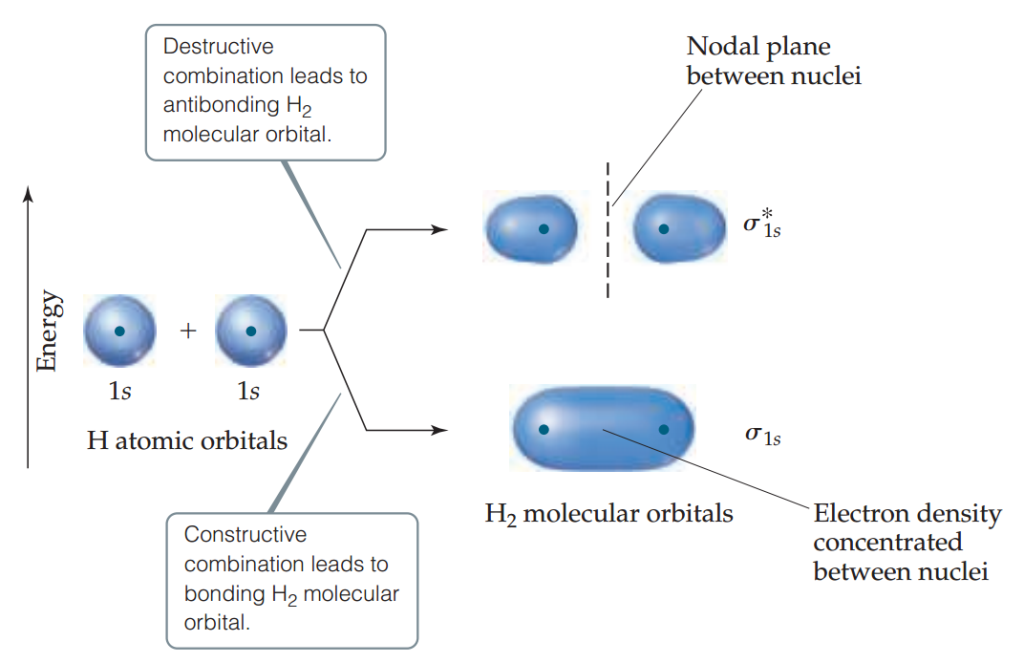
从图中可以看出,成键轨道是由两个原子轨道叠加形成的香肠型的分子轨道。因为分子轨道中的一个电子被两个原子核吸引,所以这个电子比孤立氢原子的1s原子轨道上的电子更稳定(它的能量更低)。此外,由于成键的分子轨道集中了原子核之间的电子密度,它使原子形成共价键。
相反,反键分子轨道原子核之间的电子密度非常小。在反键轨道中,原子轨道波函数不是在原子核之间的区域结合,而是在这个区域相互抵消,在两个原子核的相对两侧留下最大的电子密度。因此,反键分子轨道将电子排除在必须形成键的区域之外。反键轨道总是在原子核之间的区域有一个平面,那里的电子密度为零。该平面称为分子轨道的节点平面(以虚线表示)。反键分子轨道中的电子被排斥出成键区域,因此比氢原子的1s原子轨道中的电子更不稳定(它具有更高的能量)。
从上图看出,H2的成键分子轨道和反键分子轨道的电子密度都以核间轴为中心。这样的轨道称为σ轨道,形成的键称之为σ键。此处,成键轨道命名为σ1s,表示这个分子轨道是由两个1s轨道中的电子形成的;反键轨道命名为σ*1s。用右上角加*号的方式表示反键轨道。
两个1s原子轨道和由它们形成的分子轨道的相对能量用能级图(又称分子轨道图)表示。如下图,图中左、右为相互作用的原子轨道,中间为分子轨道。像原子轨道一样,每个分子轨道可以容纳两个自旋方向相反的电子(泡利不相容原理)。
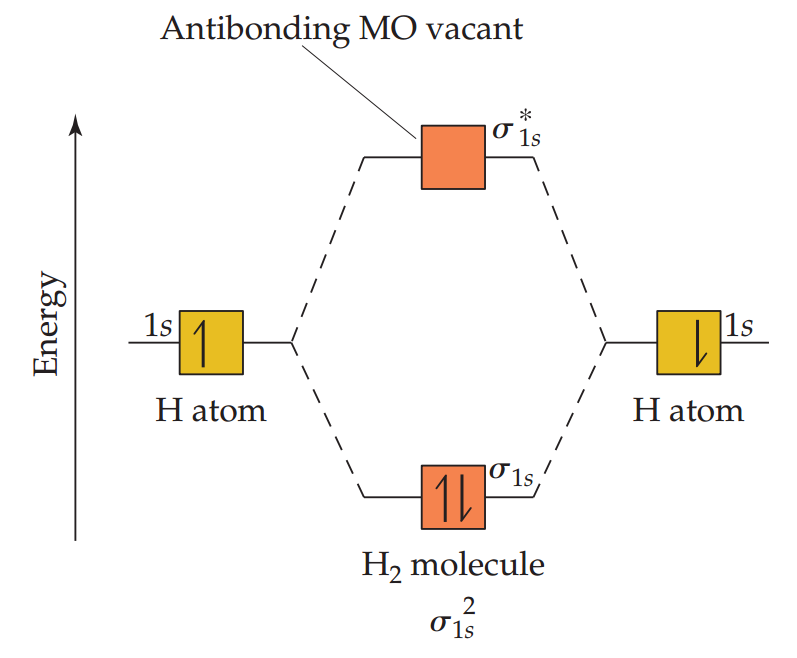
两个氢原子各自提供一个电子,占据了成键轨道,形成了一对自旋方向相反的电子对。这对成键轨道中的电子叫做成键电子。由于这对电子的能量低于单独的氢原子中电子所具有的能量,所以形成的氢气分子较单独的氢原子更加稳定。
与原子的电子排布类似,分子的电子排布可以用上标来表示电子占位。σ1s2表示1s的成键轨道中有两个电子。
2.键级(Bond Order)
在分子轨道理论中,共价键的强度用键级定义。
键级=1/2(成键轨道电子数-反键轨道电子数)
在价键理论中,键级为1表示单键,键级为2表示双键,键级为3表示三键。因为MO理论也处理含有奇数电子的分子,所以键序可能为1/2、3/2或5/2。
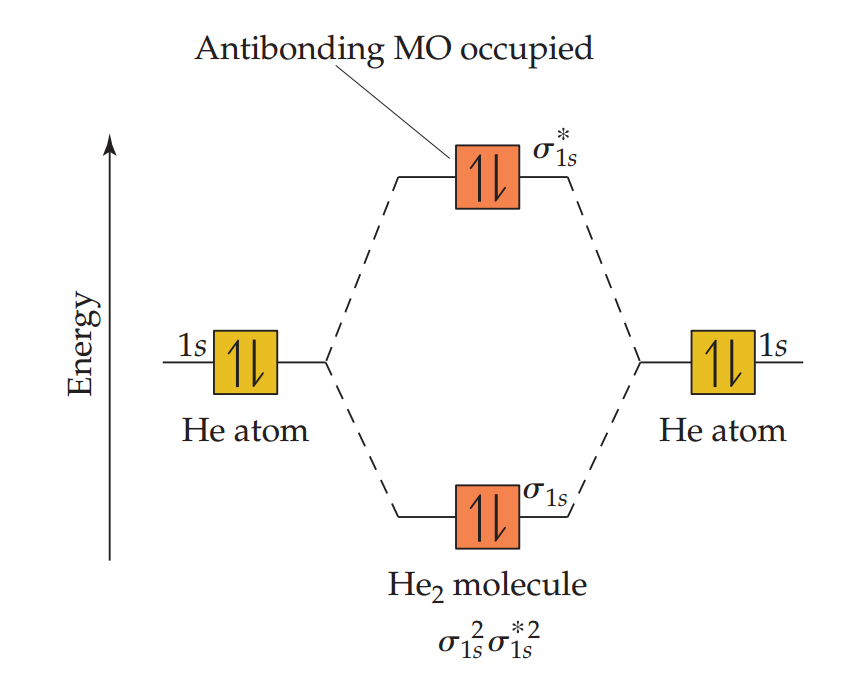
下图中显示了假想的He2分子的能级图,它需要四个电子来填满它的分子轨道。因为只有两个电子可以进入σ1s轨道,另外两个电子必须进入σ*1s轨道,因此He2的电子排布是σ1s2 σ*1s2。从He原子轨道到σ1s分子轨道中减少的能量,被从原子轨道到σ*1s2分子轨道增加的能量所抵消。因为He2有两个成键电子和两个反键电子,所以它的键级为0。键级为0表示不存在键,即氦不能形成双原子分子。
3.第二周期双原子分子的分子轨道
以下将讨论限于第二周期元素的同核双原子分子(由两个相同的原子组成的分子)。
第二周期的原子有价2s和2p轨道,我们需要考虑它们是如何相互作用形成分子轨道的。以下总结了分子轨道的形成以及它们如何被电子填充的一些指导原则:
a.形成的分子轨道数等于两原子的原子轨道数目之和。
b.原子轨道倾向于与能量相近的其他原子轨道结合。
c.两个原子轨道的重合部分越多,形成的成键分子轨道能量越低,反键分子轨道能量越高,即分裂能越大
d.每一个分子轨道最多可以容纳一对自旋方向相反的电子(泡利不相容原理)
e.当相同能量的分子轨道被填充时,在自旋配对发生之前,电子进入每个轨道(具有相同的自旋方向)(洪特规则)
3.1Li2分子轨道
基态锂原子的电子排布为1s2 2s1,当金属锂单质被加热到熔点以上(1324℃)以上时,在气相以分子的形式存在。其Lewis结构式为Li-Li,表示其有一根共价单键。我们现在通过分子轨道法来表述它的成键。
Li 1s和Li 2s原子轨道具有本质上不同的能级。由以上原则有:
a.一个Li原子上的1s轨道只与另一个原子上的1s轨道相互作用(规则2)。同样,2s轨道也只相互作用。
b.四个原子轨道的组合会产生4个分子轨道(规则1)。
如下图,Li-1s轨道结合形成成键轨道σ1s和反键轨道σ1s。2s轨道以完全相同的方式相互作用,产生成键的σ2s和反键的σ2s。
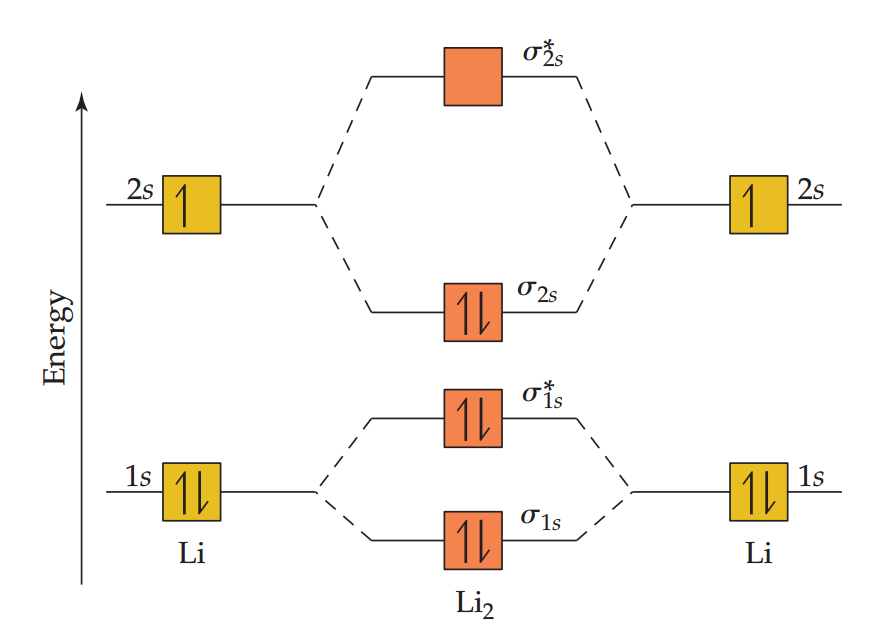
一般来说,成键和反键轨道之间的分裂能取决于组成原子轨道重叠的程度。因为Li的2s轨道比1s轨道离原子核更远,所以2s轨道的重叠更多。由原则b可知:成键轨道σ2s和反键轨道的σ*2s之间的能量差大于成键轨道σ1s和反键轨道σ*1s之间的能量差。Li的1s轨道比2s轨道能量低得多,因此,反键轨道σ*1s的能量远低于成键轨道σ2s的能量。
Li2分子轨道的能量排序为:σ1s<σ*1s<σ2s<σ*2s,电子优先填充低能量轨道。
每个Li原子有三个电子,所以Li2的分子轨道中需摆放6个电子。如上图,这些电子占据了σ1s,σ*1s,σ2s轨道,每个轨道中有两个电子。根据键级的计算公式得该分子的键级为1,所以Li2以单键连接,同价键理论分析得出的结论相符。
由于σ1s和σ*1s都被填满了,可以认为这两个轨道对于成键没有什么影响,Li2中单键的形成完全是2s轨道的电子相互作用的结果。这个例子告诉我们,非价层电子一般不会显著影响分子的成键。因此,在考虑其他第二周期双核分子的分子轨道时,可以不再考虑1s轨道的影响。
3.2Be2分子轨道
每个Be原子有4个电子,所以我们必须在分子轨道上放置8个电子。因此,我们完全填满了σ1s,σ*1s,σ2s,σ*2s分子轨道。当成键电子和反键电子数目相等时,键级为零,所以不存在Be2分子。
4.含有2p轨道的原子形成的分子轨道
在研究其他的第二周期双原子分子的分子轨道之前,我们需要了解2p轨道结合形成的分子轨道的方式。
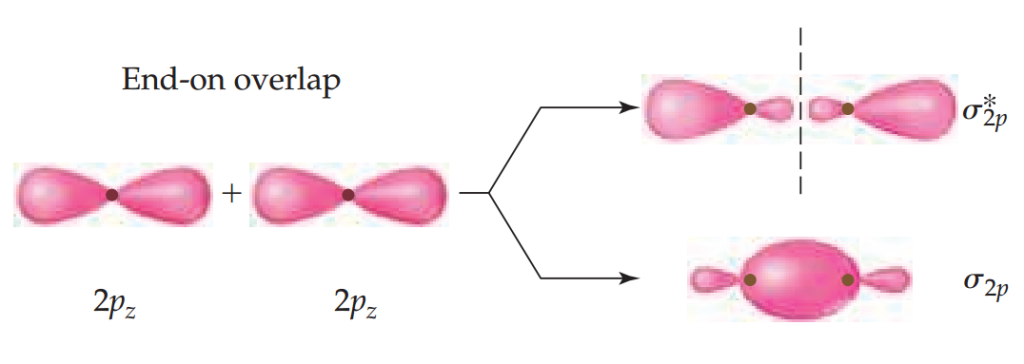
p轨道之间的相互作用如下图所示,其中我们任意选择核间轴为z轴。2pz轨道是头对头的。和s轨道一样,该轨道的结合有两种方式,分别形成成键轨道和反键轨道。其电子云密度集中在键轴上,所以把它们归类于σ轨道,命名为σ2p和σ*2p。
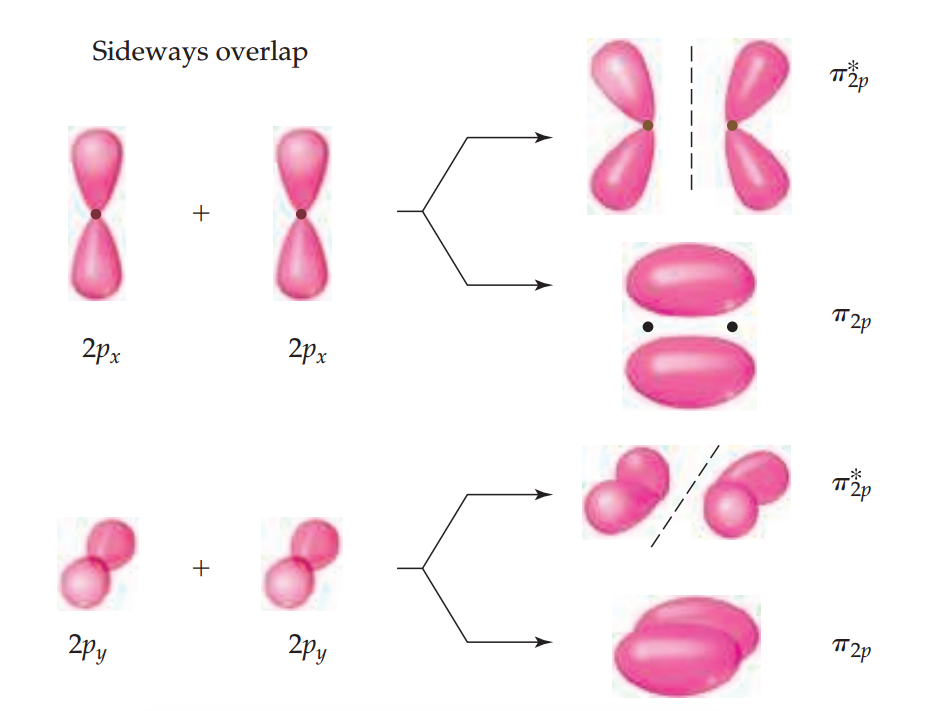
另外两个2p轨道“面对面”。在形成分子轨道时,它们的电子云密度集中在键轴的上下方,这样的分子轨道叫做π轨道,形成π键。此处的两个成键轨道可以分别形成两个π键,且能量相等,为简并能级。同理,我们也可以得到两个能量相同、互相垂直的反键轨道。该轨道形同四片叶子(lobes),叶片指向远离两个原子核的方向,如下图所示。
两个原子的2pz轨道直接指向对方。因此,两个2pz轨道的重叠大于两个2px或2py轨道的重叠。因此,我们预计σ2p分子轨道比π2p分子轨道能量更低(更稳定)。同样,σ2p分子轨道比π2p分子轨道能量高(不太稳定)。
结合对s轨道和p轨道形成分子轨道的分析,构建硼到氖元素的同核双原子分子的能级图如下,它们都有价态2s和2p原子轨道。该图的以下几点值得注意:
a. 2s原子轨道的能量比2p原子轨道低得多。因此,由2s轨道形成的两种分子轨道(成键与反键)的能量都低于由2p原子轨道产生的最低能量的分子轨道。
b. 两个2pz轨道的重叠大于两个2px或2py轨道的重叠。σ2p分子轨道比π2p分子轨道能量更低,σ2p分子轨道比π2p分子轨道能量高。
c. π2p分子轨道和π*2p分子轨道都是双简并的,即每种类型都有两个简并的分子轨道。
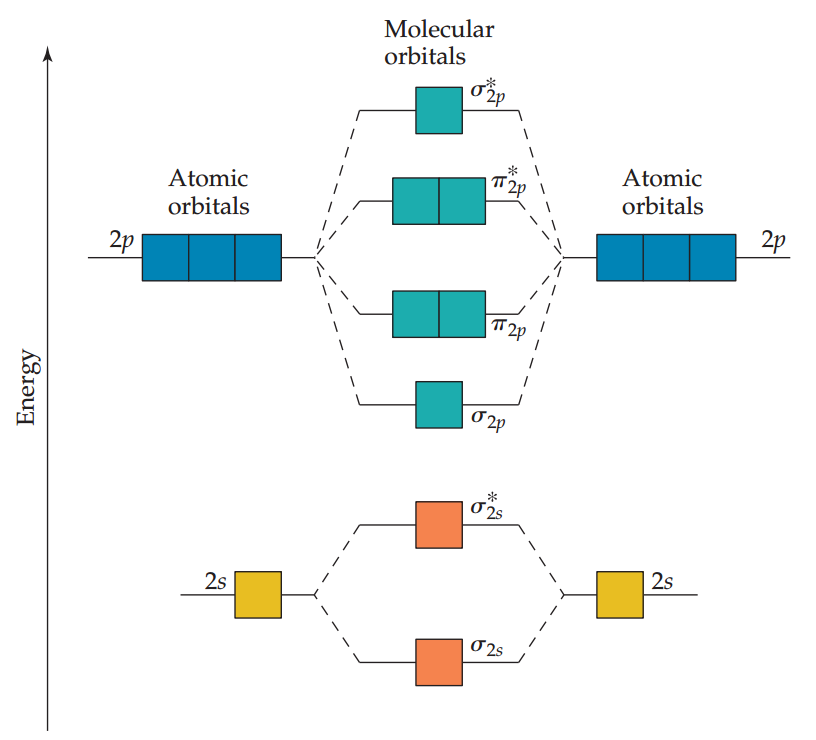
注意:
在我们把电子添加到上图之前,我们必须考虑另一个效应。在上图中,我们假设了一个原子的2s轨道和另一个原子的2p轨道之间没有相互作用。但是实际上,存在一个原子的2s轨道和另一个原子的2p轨道相互作用的例子。
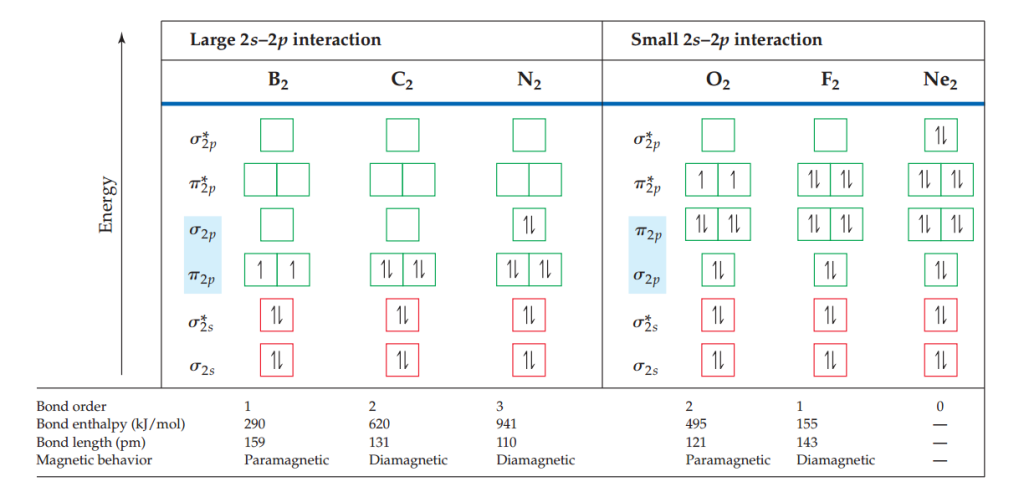
下图显示了其中一个原子的2s轨道与另一个原子的2p轨道的重叠。这些相互作用增加了σ2s和σ2p分子轨道之间的能量差,σ2s的能量减少,σ2p的能量增加。如果这种2s-2p相互作用足够强,就可以改变分子轨道的能量顺序:
a.对于B2、C2和N2,σ2p分子轨道能量高于π2p分子轨道。
b.对于O2,F2和Ne2,σ2p分子轨道能量低于π2p分子轨道。

当分子轨道中的能级排序给定时,确定到的分子轨道示意图十分容易。比如,一个硼原子有三个价电子。(注意:我们此处忽略了1s中的电子)。因此,我们要将六个电子填入其分子轨道中。它们中的四个填入σ2s和σ*2s,不参与成键;另两个价电子分别填入两个π2p,其自旋方向相同。因此,B2分子键级为1。
在第二周期中,每次我们向右移动一个元素,就必须多放置两个电子。例如,在移动到C2时,比B2多了两个电子,这些电子被放置在π2p分子轨道中,完全填满了π2p分子轨道。B2到Ne2的电子构型和键级如下图所示。
5.电子构型和分子性质
5.1在某些情况下,物质在磁场中的行为方式可以反映其电子的排列
a.具有一个或多个未成对电子的分子会被磁场吸引。
一个物种中未配对的电子越多,磁场对其吸引力就越强,这种类型的磁性行为被称为顺磁性(paramagnetism)。
b. 没有不成对电子的物质会受到磁场的微弱排斥。这种性质被称为抗磁性。
5.2键长和键能同样和分子中的电子排布方式有关
随着键级的升高,键长变短,键能升高。氮气分子的键级为3,所以它有着较短的键长和较大的键能。事实上,氮气较稳定,不易与其他物质反应生成氮化物。高键级能够解释它的稳定性。
但值得注意的是,键级相同不意味着两个不同的分子有相同的键长和键能。键级只是影响这些性质的一个因素,另外的因素包括电荷量和原子轨道之间的重合部分大小。
六.第二周期元素异核双原子分子的分子轨道
同核双原子分子的分子轨道原理可以扩展到异核双原子原子分子(分子中的两个原子不相同的分子)。
以一氧化氮(NO)为例:NO有奇数个电子,并且具有高度反应性。分子有11个价电子,可以画出两种可能的路易斯结构。

如果异核双原子分子中的原子在电负性上没有太大的差异,那么它们的分子轨道与同核双原子中的分子轨道相似,但是有两点不同需要注意:
a.电负性较高的原子的原子轨道的能量低于电负性较低元素的原子轨道。
下图中,氧的2s和2p原子轨道略低于氮的轨道,因为氧比氮的电负性更强。NO的分子轨道能级图很像同核双原子分子,这是因为两个原子上的2s和2p轨道彼此相互作用,产生了相同类型的分子轨道。
b.虽然此处分子轨道依然是两个原子轨道相互作用形成的,但是总的来说,形成的分子轨道中,与该分子轨道能量相近的原子轨道对其贡献更大。
NO中的σ2s分子轨道能量和O原子中的2s轨道能量更接近,所以O对σ2s分子轨道形成的贡献更大。因此,该分子轨道不是两个原子等价形成的。同理,σ*2s反键分子轨道偏向N原子一侧,因为该轨道的能量更接近于N原子中的2s轨道。
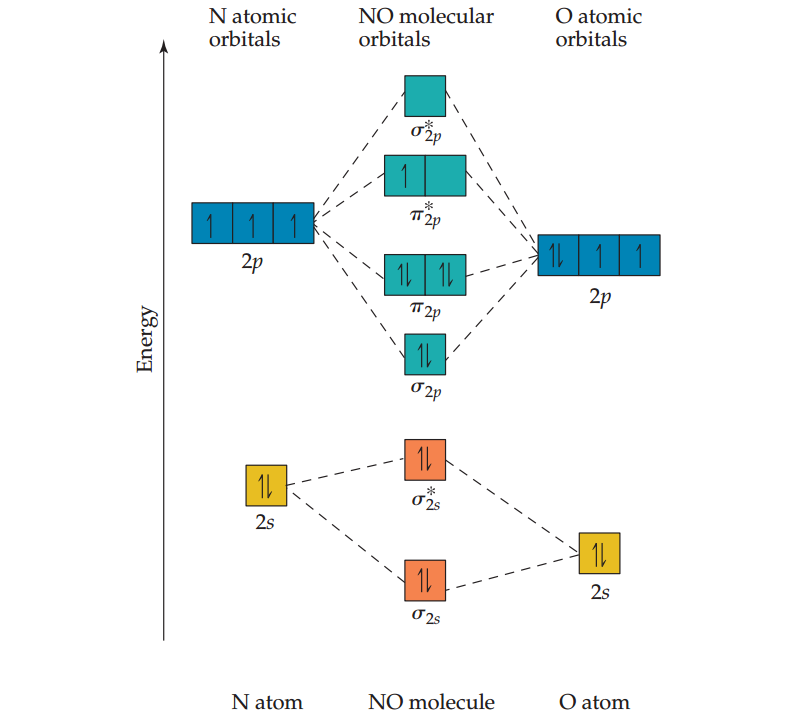
我们用11个价电子填充上图中的分子轨道来完成NO的分子轨道图。通过八个成键电子和三个反键电子计算:
NO键级=1/2(8-3)=2.5
未配对的电子存在于一个π*2p分子轨道中,其中N原子的贡献更大。因此,把不成对的电子放在氮上的Lewis结构(基于形式电荷的优选结构)是对分子中真实电子分布的更准确描述。
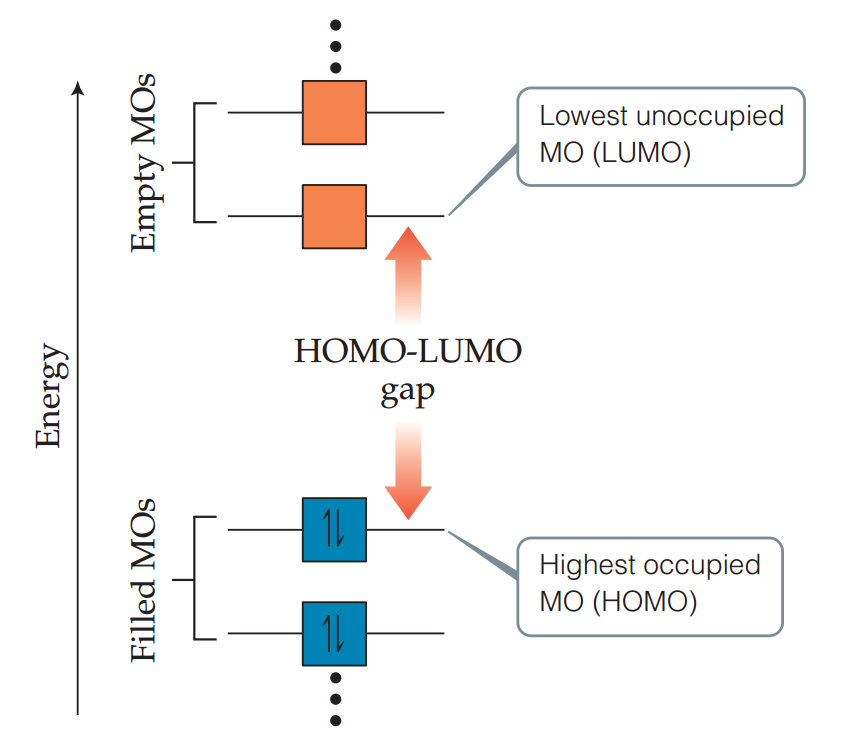
七.分子轨道和能量
如下图,最高的被填充分子轨道(Highest Occupied Molecular Orbital, HOMO)中有着该分子基态的最高能量电子。最低未填充轨道(Lowest Unoccupied Molecular Orbital, LUMO)是空轨道中能量最低的。在氮气分子中,HOMO轨道是σ2p,LUMO为π*2p。