锂离子电池SEI膜
这期我们一起讨论一下锂离子电池中一个极其关键的组份—SEI膜。事实上,国内外对于SEI膜的研究已经非常成熟,各种技术性文章和资料网上比比皆是,本人不再重复赘述,这期主要论述一些我们锂电池生产技术工作者对SEI膜的理解模糊或疑惑的地方,以供参考。
先看SEI膜微观结构和成分:

石墨负极SEI组合图

SEI膜一点也不神秘,只是英文固体电解质介膜的缩写,实质上是电极表面的一些氧化还原产物,没有活性的钝化膜。
以上两个图片可以直观看到SEI膜微观结构和主要组分。微观结构来看,SEI膜分布在石墨二次颗粒的表面,初膜厚度100-200nm,而且存在微孔可供Li离子穿梭。具体组分来看,最内层是碳酸锂、氢氧化锂、氧化锂混合的无机锂盐,外层为碳酸酯锂为主的有机锂盐,石墨-内层-外层通过范德华力或者普通物理附着组合在一起。
锂离子电池制作过程中,由于材料本身和生产外部环境因素,电芯内部肯定会含有痕量水分和HF,尽管浓度极低,但因其得电子能力极强,总体反应动力学依然可观,会首先和负极碳化锂反应生成无机锂盐;后续才继续会发生电解液溶剂的氧化还原反应,生成有机锂盐。因为我们锂离子电池所用电解液溶剂基本上是DMC/EMC/EC三者碳酸酯类混合,所以产物为碳酸酯锂盐。
表面看,电解液溶剂都是碳酸酯类,得电子能力极弱,基本无法和金属锂发生氧化反应,又如何会在负极表面生成有机锂盐呢?事实上这里涉及到化学反应动力学的很多影响因素,如温度、浓度、压强、磁场电压等,还有个重要因素:锂离子电池在实际化成过程中,负极新生成的产物活性极强近乎单个锂原子的活性,很容易发生反应。所以最终有机溶剂的反应如下:
PC + 2 e – + 2Li+ →CH3CH(OCO2Li) CH2 (OCO2Li) ↓+ CH3CH=CH2 ↑
2EC + 2 e – + 2Li+ →(CH2OCO2Li) 2 ↓+ CH2 =CH2 ↑
进而,综合SEI膜反应机理,可以得出其一般普通情况下主要产气的成分和大概比例了,当然随着材料体系和化成方式不同也会有变化。以某体系电池举例如下:
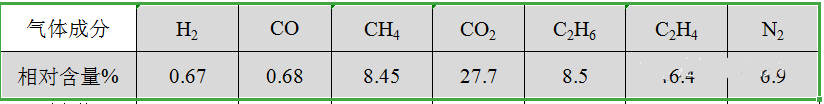
表中可以看出其主要产气成分为乙烯,占到46.4%,其次还有甲烷,二氧化碳,氢气等。据此,这里就有个思路,可以利用化成产气成分和比例来检测电芯是否漏液。如利用高精度可燃气体检测仪检测是否出现可燃气体(乙烯、甲烷等)来进行判断。这里不赘述,本人之前已申请专利,感兴趣的可以专利上进行搜索查看。
由于液态锂离子电池的固有特性,毋庸置疑,SEI膜肯定一直存在于负极表面。由于其组分最多的为有机锂盐,有机盐很不稳定,特别在高温下极容易分解;再者,SEI膜和负极及各膜层之间通过化学键较弱的范德华力,甚至普通物理附着结合一起,所以随着充放电过程中负极微观结构的膨胀收缩,SEI膜极易断裂脱落。如此便会有新的SEI膜生成,进而消耗有效锂源。而脱落的SEI膜微观微粒会穿插或者附着在负极表面,堵塞锂离子微孔通道,进一步降低锂离子迁移速速,增加阻抗。更严重的是由于无序、无规则脱落锂盐的存在,会严重影响新生成的SEI膜强度,使其进一步连锁加剧恶化。这也是影响锂离子电池使用寿命的一个无法避免的因素
最后辩证看一下SEI膜利弊作用。自然,SEI膜的形成组份都是锂盐,这些锂盐都来自正极的有效锂源,最终导致了锂离子电池的不可逆有效容量损失。但这些无机有机锂盐形成的钝化膜具有有机溶剂不溶性,在有机电解质溶液中能稳定存在,并且溶剂分子不能通过该层钝化膜,从而能有效防止溶剂分子的共嵌入,避免了因溶剂分子共嵌入对电极材料造成的破坏,因而大大提高了电极的循环性能和使用寿命。事实上,这层钝化膜肯定会形成,都无法阻止,所谓存在即合理,就这么简单
由于SEI膜的形成消耗了有效锂,造成了锂离子电池的不可逆容量损失。所以相应的出现电芯设计中N/P比的合理值;正负极补锂技术等。
综上所述为各类技术文章中较少提及或未提及的关于SEI膜的原理解释和理论,提出来供各位行业同仁参考。
