什么是电催化
一.为什么会有电催化?为什么要研究电催化?
1.1从电极反应说起
电极反应是伴有电极|溶液界面电荷传递步骤的多相化学过程,影响其反应速度的因素有:
1.温度、压力、溶液介质、固体表面状态、传质条件
2.施加于电极|溶液界面的电场
在许多电化学反应中电极电势每改变1V可使电极反应速度改变1010倍,而对一般的化学反应,如果反应活化能为40kJ·mol-1,反应温度从25℃升高到1000℃时反应速度才提高105倍。显然,电极反应的速度可以通过改变电极电势加以控制,因为通过外部施加到电极上的电位可以方便地改变反应的活化能。
3.电极|溶液界面的双电层结构
电极附近的离子分布和电位分布均与双电层结构有关。因此,电极反应的速度可以通过修饰电极的表面而加以调控。
实际问题的关键在于:
许多化学反应尽管在热力学上是有利的,但它们自身并不能以显著的速率发生。所以为了提高反应进行的速度,结合上述影响电极反应速度的因素,发现降低反应活化能是较为有效的方法。
所以我们在电化学反应的基础上,用催化材料作为电极或在电极表面修饰催化剂材料,从而降低反应的活化能,提升电化学反应的效率,这就叫电催化反应。
1.2电催化的反应速度受什么影响?
1.催化剂的活性决定
2.界面电场及电解质的本性
由于界面电场强度很高,对参加电化学反应的分子或离子具有明显的活化作用,使反应所需的活化能显著降低。所以大部分电化学反应可以在远比通常化学反应低得多的温度下进行。
电催化的作用是:通过增加电极反应的标准速率常数,而使得产生的法拉第电流增加。
那么为什么不用电流来评量电催化的效率?
在实际电催化反应体系中,法拉第电流的增加常常被另一些非电化学速率控制步骤所掩盖,所以通常在给定的电流密度下,从电极反应具有低的过电位来简明而直观地判明电催化效果。
二.电催化的反应过程有何特点?
2.1是有中间物生成的连续步骤
电催化的反应过程都包含两个以上的连续步骤,且在电极表面上生成化学吸附中间物。许多由离子生成分子或使分子降解的重要电极反应均属电催化反应,主要分成两类。
(1)第一类反应:氢电极过程、氧电极过程等
第一步:离子或分子通过电子传递步骤在电极表面产生化学吸附中间物;
第二步:化学吸附中间物经过异相化学步骤或电化学脱附步骤生成稳定的分子。
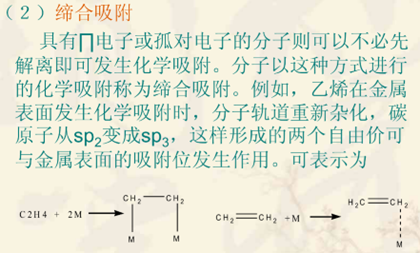
(2)第二类反应:
第一步:反应物首先在电极表面上进行解离式或缔合式化学吸附;
第二步:化学中间物或吸附反应物进行电子传递或表面化学反应。

2.2受电极电位的影响
电催化反应突出的特点是电催化反应的速度除受温度、浓度和压力等因素的影响外,还受电极电位的影响,表现在以下几个方面:
1.在上述第一类反应中,化学吸附中间物是由溶液中物种发生电极反应产生的,其生成速度和电极表面覆盖度与电极电位有关;
2.电催化反应发生在电极|溶液界面,改变电极电位将导致金属电极表面电荷密度发生改变,从而使电极表面呈现出可调变的Lewis酸-碱特征;
3.电极电位的变化直接影响电极|溶液界面上离子的吸附和溶剂的取向,进而影响到电催化反应中反应物种和中间物种的吸附;
4.在上述第二类反应中形成的吸附中间物种通常借助电子传递步骤进行脱附,或者与在电极上的其它化学吸附物种(如OH或O)进行表面反应而脱附,其速度均与电极电位有关。由于电极|溶液界面上的电位差可在较大范围内随意地变化,通过改变电极材料和电极电位可以方便而有效地控制电催化反应速度和选择性。
