什么是前线轨道理论
在催化反应中,催化剂的催化活性同催化剂的电子构型和几何构型密切相关,由此发展出了许多表征催化剂活性与电子构型关联的理论和模型。目前主要使用的有前线分子轨道理论和d能带中心模型。在电催化反应中,包括了物种的吸附和电子的转移。其电子的转移难易可以通过催化剂的前线分子轨道来进行定性了解;而物种的吸附则可以通过d能带中心模型有效的模拟。
一.什么是前线轨道理论?
前线轨道理论前线轨道理论是诺贝尔奖获得者福井谦一教授在1952年提出的,其认为化学反应主要受前线轨道的非定域化作用支配,其化学反应的条件和方式主要取决于前线轨道。
前线轨道主要包括了最高占据轨道(HOMO)和最低空轨道(LUMO)。
a.HOMO对电子的束缚力较弱,具有电子给体的性质;
b.LUMO对于电子的亲和力较强,具有电子受体的性质。
A、B两个分子沿着最小运动途径发生轨道正重叠时给反应体系带来非定域化能,称为稳定化能。
a.当A、B分子在最小运动途径上运动时,其HOMO和LUMO能够发生最好的轨道重叠,这时会给反应体系带来较大的稳定化能,则反应可以进行。
b.当两个轨道在最小运动途径上运动时,不发生轨道的正重叠,则反应不能进行。
这种定域化所控制的化学反应的速率P取决于两个前线轨道的相互作用能,即稳定化能P与ΔE成正比,有:
P∝ΔE
根据成键三原则,稳定化能与两个轨道的重叠积分成正比,与两个轨道的能级差成反比,上式可写为:
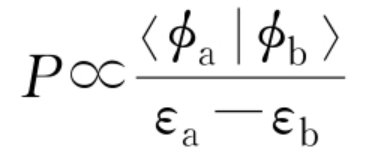
两个轨道能级越接近,两个轨道的重叠越好,因此成键三原则可归结为轨道最大正重叠原则,这就说明了化学反应是沿着轨道发生最大正重叠的途径进行的。
在电化学反应中,电子的转移主要发生在供体与受体之间。
例如电催化还原反应,此时电极催化剂为供体(D),反应分子为受体(A),当催化剂的HOMO同反应分子的LUMO能级接近且对称性匹配,则电子转移反应能够顺利发生,此时发生电催化还原反应。因此,可以通过催化剂与反应分子之间前线轨道的能级接近程度以及对称性匹配程度来判断电子转移的难易和催化剂的活性。
二.怎样使用前线轨道理论
影响着电子转移速率的有两点因素:一是前线轨道之间的能级差;二是电子给体的HOMO与电子受体LUMO轨道间的空间尺寸和对称性。可以通过这两点为入手点来判断催化活性。
2.1前线轨道之间的能级差
以Ni及其Ni-P无定形合金电化学析氢的催化活性为例子:
碱性介质中,析氢过程是从金属表面水分子的放电开始的,这个反应为(Volmer反应):

接着可能发生的是H的电化学脱附反应(Heyrovsky反应):
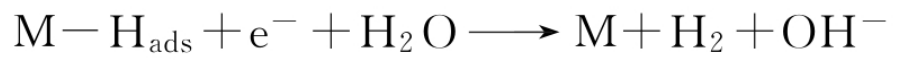
或者是H的复合脱附反应(Tafel反应):

另外,吸附的原子H也可能被吸收到电极内:
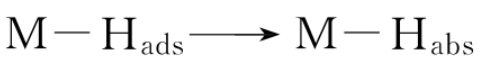
按照前线轨道理论,有:
a.对反应式1,电子转移发生在金属M的HOMO能级与H2O的LUMO能级之间;
b.反应式2,则是电子从M-Hads的HOMO能级转移到H2O的LUMO能级上;
c.对反应式3,没有电子转移,则需要M与Hads的成键能越小,H2的析出越容易。
由此,对Ni-P合金上的析氢反应,H2O从金属电极的HOMO能级上得电子的能力以及Hads的结合能决定着Ni-P的活性。
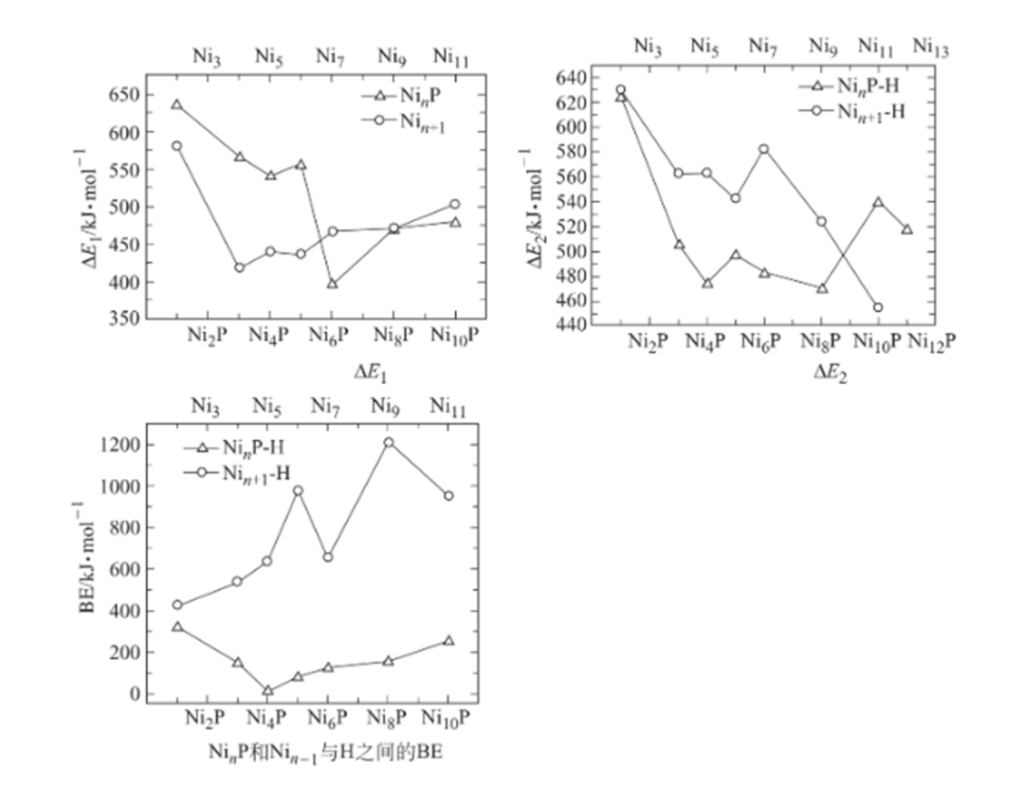
由于只有当HOMO与LUMO之间的能级差小于579kJ·mol-1,电子转移反应才会发生,并且能级差越小,电子转移反应越容易。H2O的LUMO能级为66kJ·mol-1,因此:
1.计算Ni及Ni-P合金的HOMO与H2O的LUMO能级之间差ΔE1,
2.计算Ni-Hads及Ni-P-Hads合金的HOMO与H2O的LUMO能级之间差ΔE2,
3.比较ΔE1与ΔE2,来判断电子转移的难易程度
4.通过计算Ni与Hads和Ni-P与Hads之间的结合能BE,以此反映吸附氢脱离金属催化剂的难易程度。
如下图所示:
a.在Ni与Ni-P上,H2O获得1个电子,当Ni∶P小于6∶1时,在Ni上较Ni-P上容易;
b.在Ni-H与Ni-P-H上,H2O获得1个电子,当Ni∶P小于8:1时,在Ni-P-H上较Ni-H上容易
c.无论Ni-P中P含量如何,Hads与Ni的结合能始终比Ni-P-H更强,表明在Ni上的氢脱附较Ni-P上困难。
综合以上分析,对Ni-P合金,P的含量应控制在Ni∶P比在6:1~8:1的范围,换言之,Ni-P合金中,P的含量在9.1%~14.3%,对析氢反应的活性最好。
2.2电子给体的HOMO与电子受体LUMO轨道间的空间尺寸和对称性
以Pt、Pd纳米粒子负载在炭黑和TiO2纳米管上对氧气电化学还原(ORR)出现催化活性反转为例:
ORR中,O2分子为电子受体,其LUMO能级的轨道对称性和空间尺寸一定。尽管Pt/C与Pd/C的HOMO能级均与氧气LUMO满足对称性匹配,但轨道的空间尺寸大小却不相同。Pd/C的HOMO能级主要由载体C的p轨道和小部分Pd的d轨道组成,而Pt/C的HOMO能级则主要由Pt的d轨道和载体C的π轨道组成。Pt/C HOMO的空间尺寸与O2 LUMO的尺寸相当,轨道之间有更有效的重叠。根据最大重叠原则,Pt/C上的ORR第一步电子转移反应较Pd/C更为容易。
当Pd负载在TiO2载体上时,TiO2载体明显增大了Pd/TiO2 HOMO轨道的空间尺寸,克服了Pd/C HOMO与O2 LUMO重叠差造成的电子转移困难的问题,更利于O2第一步电子转移。
除了直接通过催化剂与反应物种前线分子轨道的能级接近程度以及对称性匹配程度来判断电子转移的难易和催化剂的活性外,还可以通过HOMO和LUMO能级推导出与催化活性和电化学反应速率相关的其它参数来表征和模拟催化剂的催化活性。
