为什么锂离子电池不同正负极材料有不同的电压平台
锂离子电池不同的正负极材料(磷酸铁锂、三元、钴酸锂、锰酸锂、钛酸锂)会出现不同形式的充放电平台。有的材料(磷酸铁锂、钛酸锂)充放电平台的斜率很小,有的材料(三元、钴酸锂、锰酸锂)充放电平台的斜率较大。这是为什么,是由什么因素决定的?下面分别从吉布斯相律、电化学热力学和分子轨道理论的角度进行解释,可以参考物理化学书中的章节了解相关概念和理论。
吉布斯相律
先回顾一下固溶体和两相共存的区别。如果把固体想象成一种特殊的液体的话,固溶体可以理解成酒精和水的混合物,无论酒精和水的比例各为多少,它们都能溶解成组分均一的液体。两相共存则可以理解成油和水,在较大的范围内混合都会出现油水分离的现象,不能溶解成组分均一的液体。固溶体长程有序,而两相共存只在小范围内的晶体结构均一。
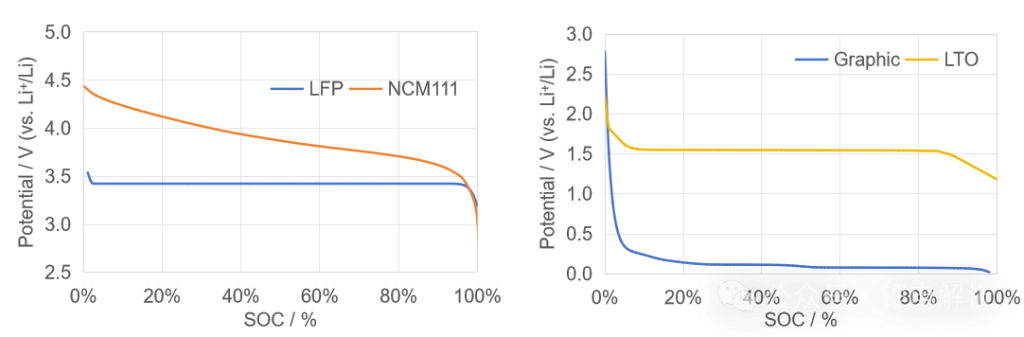
钴酸锂、三元呈现出固溶体材料的特性,即其两种组分LiMO₂与MO₂可在不同的锂浓度下”互溶”。换句话说,脱嵌锂的过程为单相固溶体反应(LiMO2与MO2互溶)。根据吉布斯相律:自由度F=C-P+n=2-1+0 =1,其中组元C=2(LiMO2与MO2),相数P=1(互溶的固相),电压是自由的,随锂含量连续变化。在宏观上表现为充放电曲线呈斜率(如三元材料斜率约0.1V/100mAh)。
磷酸铁锂、钛酸锂呈现出两相共存的材料特性,即其两种组分LiFePO4与FePO4是独立存在的两相。在脱嵌锂过程中,这两相共存,根据吉布斯相律:自由度F=2-2+0=0,其中组元C=2(LiFePO4与FePO4),相数P=2(独立存在的两相),电压是固定的,不随锂含量连续变化。
热力学
在等温、等压可逆电池反应中,电功的最大值为吉布斯自由能的变化值,即:
∆G = nFE
其中∆G为吉布斯自由能的变化量,n为电池反应中转移的电子数,F为法拉第常数,E为该反应的可逆电动势。对于固溶体特性的材料(以三元材料为例,M代表Ni/Co/Mn),其电化学反应可表示为:
Li1-nMO2→Li1-n-xMO2+xLi++xe–
3.5~4.2V vs.Li+/Li
不同反应程度(x mol反应)下,其反应前后的材料都是不同的,也就是Li1-nMO2和Li1-n-xMO2会随着n的变化而变化。这意味着,不同嵌锂态的固溶体材料的脱嵌锂的反应吉布斯自由能是不同的,其电势也就会发生变化。
对于两相共存的材料(以磷酸铁锂为例),其电化学反应可表示为:
LiFePO4→FePO4+xLi++xe– 3.4V vs.Li+/Li
不同反应程度(x mol反应)下,其反应前后的材料是相同的。其吉布斯自由能的变化均为∆G =G(FePO4)+G(Li+)+G(e–)-G(LiFePO4)。这意味着,不同嵌锂态的两相共存材料的脱嵌锂的反应吉布斯自由能是相同的,其电势也就不会发生变化。
分子轨道理论
材料中的过渡金属(Co, Mn, Ni)与氧形成层状或尖晶石结构,其分子轨道(如Co的3d轨道与O的2p轨道杂化)形成连续的能带。在充放电过程,锂离子脱嵌时,过渡金属价态连续变化(如Co3+/Co4+),电子在连续能带中跃迁,导致化学势(电压)随锂含量渐变,形成倾斜的充放电曲线。关于过渡金属的价态连续变化,可通过X射线吸收光谱(XAS)观测到,充电过程中Co的K边能量连续漂移,证实价态渐变(非阶跃变化)。
Fe与O形成橄榄石结构,FeO6八面体中的Fe 3d轨道(t2g)与O2p轨道杂化,能级分裂明显。脱锂时,Fe²⁺(t2g4 eg2)→Fe3+(t2g3 eg2)的跃迁需克服较大能垒,导致电子跃迁不连续。充放电在LiFePO4和FePO4两相界面进行,二者均为正交晶系且结构相似,分子轨道能级突变,电压几乎不变,形成平坦曲线。
做个不准确但形象的类比,可以将三元材料中的外层电子是均匀分布在整个晶体中的(准确来说是局域的),该晶体中的过渡金属元素拥有同一个平均价态。不同嵌锂态对应不同的过渡金属元素价态,也就对应不同的电子浓度和电子能级。其得失电子时对应的电子跃迁能也就是连续变化的,即电势是连续变化的。而磷酸铁锂的电子跃迁在LiFePO4和FePO4两相界面进行,其电子跃迁能是固定的,即电势几乎不变。
